「警告・禁忌を含む注意事項等情報」等は電子添文をご参照ください。
国際共同第Ⅲ相臨床試験
(IM011-046試験)
POETYK PSO-1(日本人を含む)
社内資料:国際共同第Ⅲ相試験(IM011-046試験)[POETYK PSO-1](承認時評価資料)
Armstrong AW, et al.:J Am Acad Dermatol. 2023;88:29-39.
[利益相反]資金提供 : Bristol-Myers Squibb社、著者に助成金を受領しているものが含まれる。
有効性・安全性については、試験概要をご確認後、ページ下部へのスクロールにてご確認いただけます。
試験概要
- 目的
-
中等症から重症の局面型皮疹を有する乾癬患者を対象に、投与16週のPASI 75及びsPGA 0/1達成率により、ソーティクツのプラセボに対する優越性を検証し、安全性を検討する。
- 対象
-
中等症から重症の局面型皮疹を有する乾癬患者666例(日本人66例含む)
局面型皮疹の病変が体表面積(BSA)の10%以上、PASIスコアが12以上、かつsPGA(医師による静的総合評価)スコアが3(中等度)以上の患者
- 試験方法
-
- ・ 患者をソーティクツ群(6mg1日1回経口投与)、プラセボ群、アプレミラスト群(30mg1日2回経口投与まで漸増※2)に2:1:1の比でランダムに割り付けた。なお、患者を地域(米国、日本、中国又はその他)、生物製剤使用歴の有無(乾癬、関節症性乾癬又はその他の炎症性疾患のみ)及び体重(90kg以上又は90kg未満、日本及び中国には適用せず)で層別化した。
- ・ ソーティクツ群は、52週まで継続した。
- ・ プラセボ群では、投与16週に全ての患者を盲検下でソーティクツ(6mg1日1回)に切り替え、プラセボ-ソーティクツ群として52週まで継続した。
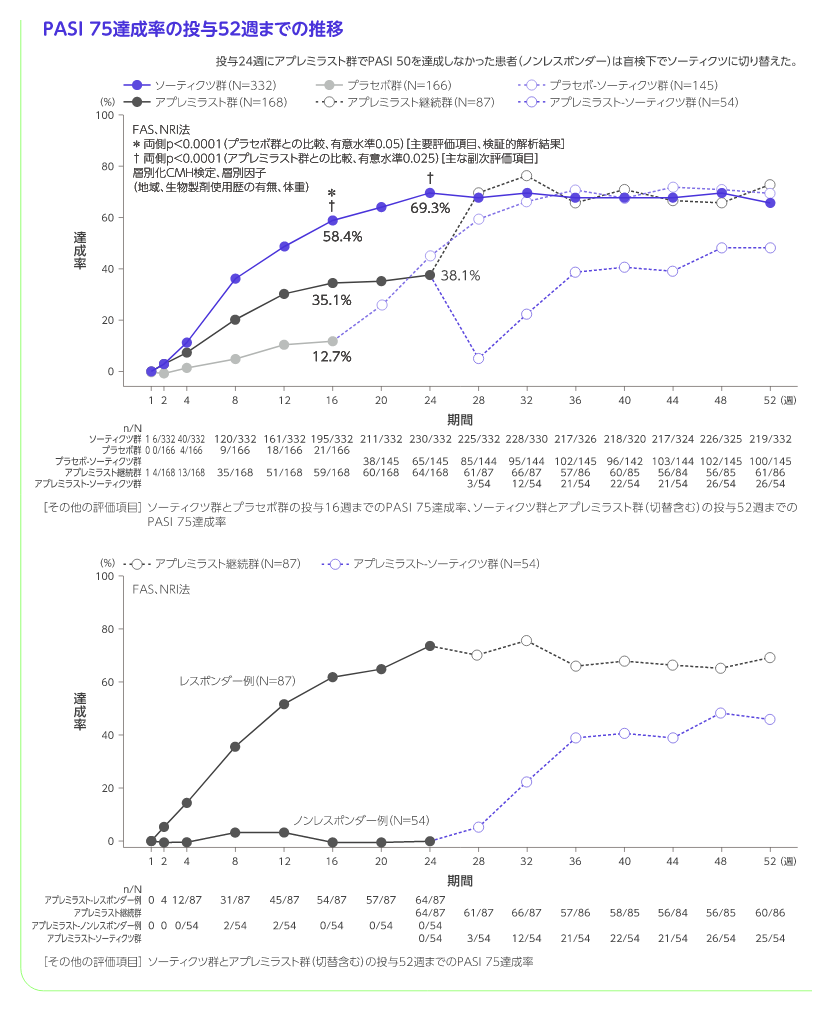
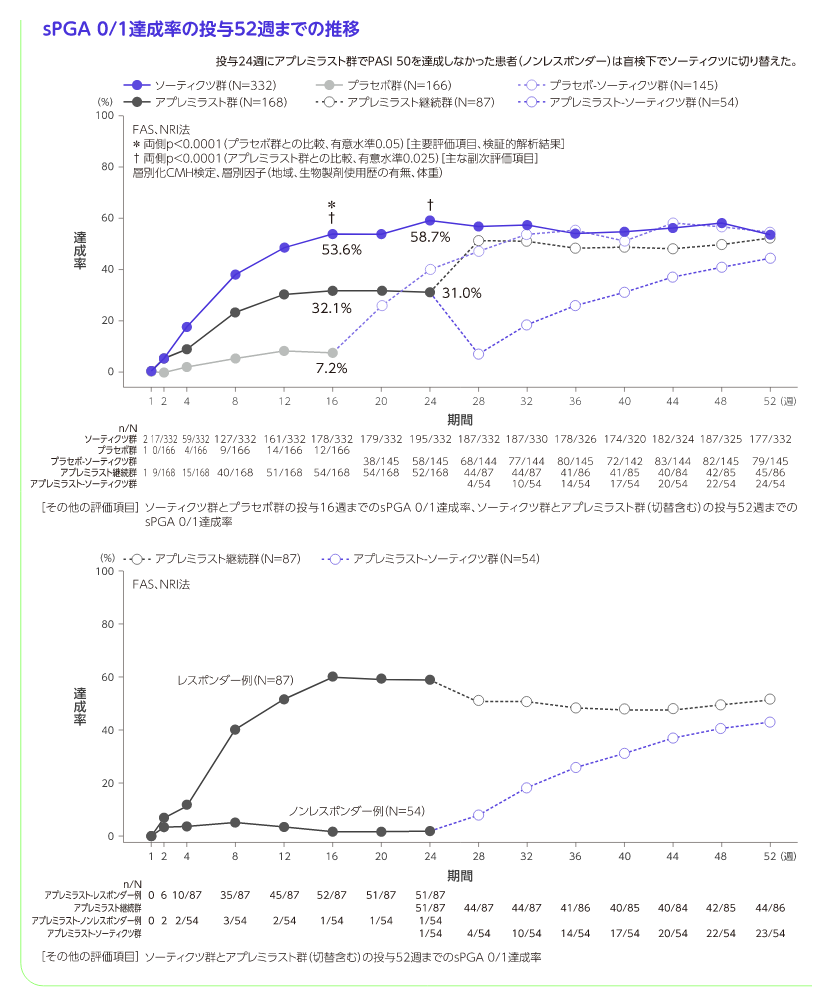
- ・ アプレミラスト群では、投与24週にPASI 50を達成した患者(レスポンダー例)はアプレミラスト(30mg1日2回)を盲検下で52週まで継続し(アプレミラスト継続群)、アプレミラスト群でPASI 50を達成しなかった患者(ノンレスポンダー例)を盲検下でソーティクツ(6mg1日1回)に切り替え、アプレミラスト-ソーティクツ群として52週まで継続した。
- ・ 投与24週にsPGAが3以上又はss-PGAが3以上で身体又は頭皮に中等度以上の病変を有することが示唆される患者は、制限された外用治療薬又はシャンプーによる治療を治験担当医師の判断で開始できることとし、52週まで継続可能とした。
- ・ 患者は投与52週に投与期間を完了し、適格となった患者は長期継続試験であるIM011-075試験に移行し、投与を継続した。
- 評価項目
-
-
主要評価項目
ソーティクツとプラセボの比較
・投与16週のPASI 75及びsPGA 0/1達成率(検証的な解析項目)
-
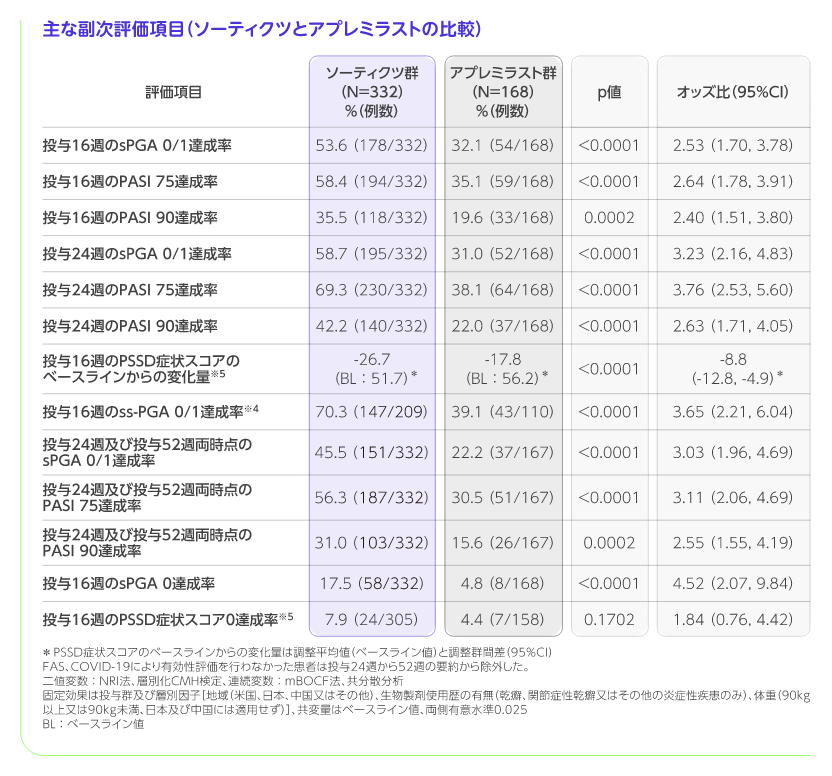
主な副次評価項目
-
ソーティクツとプラセボの比較
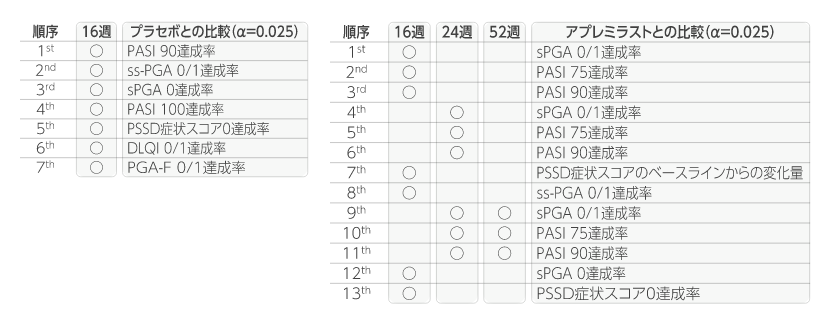
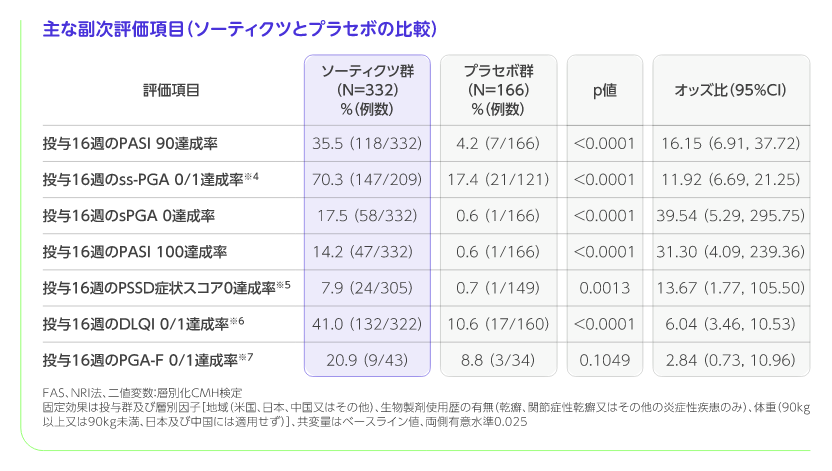
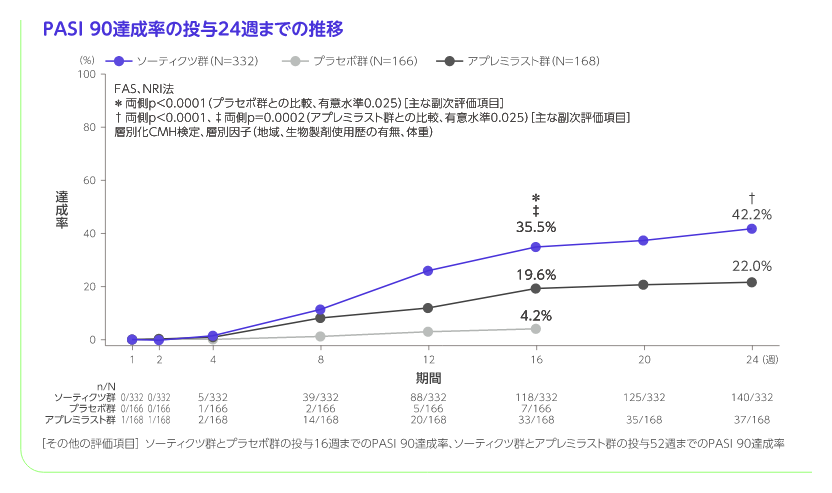
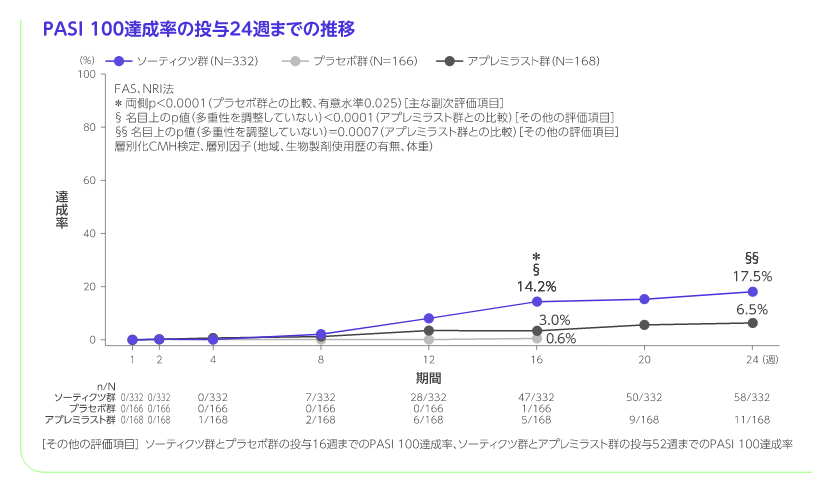
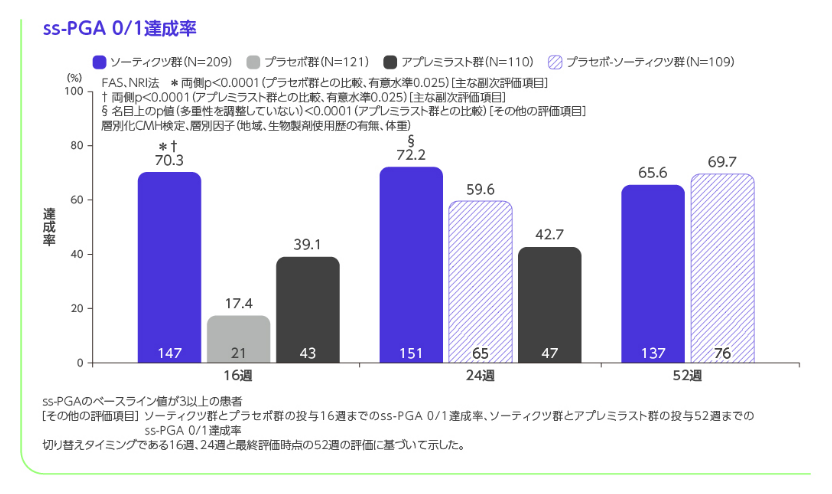
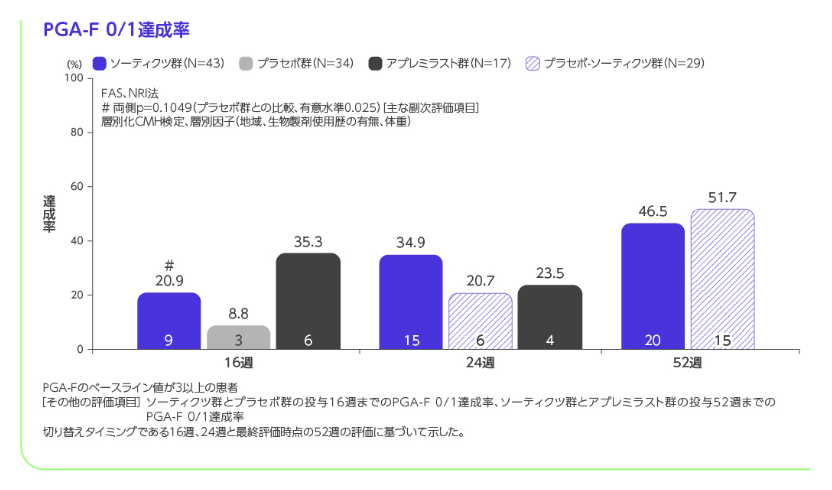
- 投与16週のPASI 90、ss-PGA 0/1※4、sPGA 0、PASI 100、PSSD症状スコア0※5、DLQI 0/1※6、PGA-F 0/1※7達成率
-
ソーティクツとアプレミラストの比較
- ・投与16週のsPGA 0/1、PASI 75、PASI 90達成率、PSSD症状スコアのベースラインからの変化量※5、ss-PGA 0/1※4、sPGA 0、PSSD症状スコア0※5達成率
- ・投与24週のsPGA 0/1、PASI 75、PASI 90達成率
- ・投与24週及び投与52週両時点のsPGA 0/1、PASI 75、PASI 90達成率
-
-
その他の評価項目
- ・ソーティクツ群とプラセボ群の投与16週までのPASI 75、PASI 90、PASI 100、sPGA 0/1、sPGA 0、ss-PGA 0/1※4、PGA-F 0/1※7達成率 等
- ・ソーティクツ群とアプレミラスト群(切替含む)の投与52週までのPASI 75、PASI 90、PASI 100、sPGA 0/1、sPGA 0、ss-PGA 0/1※4、PGA-F 0/1※7達成率 等
-
安全性評価項目
- ・有害事象 等
-
- 解析計画
-
-
有効性評価項目及び安全性評価項目は、投与16週までのプラセボ群、投与52週までのソーティクツ群、プラセボ-ソーティクツ群、アプレミラスト群を解析した。アプレミラスト群は投与24週の切り替えに伴い、アプレミラスト継続群(レスポンダー例)及びアプレミラスト-ソーティクツ群(ノンレスポンダー例)として解析した。
主要評価項目
投与16週のPASI 75及びsPGA 0/1達成率について、プラセボに対するソーティクツの有意性をそれぞれ両側有意水準0.05で検定した。解析には、地域、生物製剤使用歴の有無及び体重を層別因子としたCochran-Mantel-Haenszel(CMH)検定を用い、プラセボに対するソーティクツのオッズ比及びその両側95%信頼区間とp値を算出した。欠測値はNRI法により補完した。また、ソーティクツ群とプラセボ群を比較し、Mantel-Haenszel法を用いて投与群間差及びその95%信頼区間を算出した。
-
主な副次評価項目
二つの主要評価項目の両方で統計学的有意差が認められた場合に、ソーティクツとプラセボとの比較、ソーティクツとアプレミラストとの比較を、それぞれ別の検定グループとして両側有意水準0.025で検定した。各グループ内で階層的検定手順を用い、統計学的に有意な結果が得られた場合のみ次の項目に進むこととした。
二値変数の有効性評価項目の解析は主要評価項目と同じ方法を用い、欠測値はNRI法により補完した。連続変数の有効性評価項目の各時点における比較には、投与群及びランダム化層別因子を固定効果、ベースライン値を共変量とする共分散分析モデルを用い、欠測値はmBOCF法により補完した。また、ソーティクツ群とプラセボ群又はアプレミラスト群との群間差(調整済み最小2乗平均値に基づく)及びその両側95%信頼区間を算出した。
効果不十分又は有害事象により治験薬の投与を中止した患者は、中止以降の全ての評価時点で、ベースライン時の測定値を繰り越した。他の理由で比較時点より前に治験薬の投与を中止した患者、又は比較時点で欠測値があった患者は、最後の有効な測定値(該当する場合、ベースライン値も含む)を繰り越した。ベースライン値が欠測している患者は、ベースラインからの変化量の解析から除外した。 -
その他の評価項目
全ての有効性評価項目は推定値とともに両側95%信頼区間を算出し、各評価項目の検定は名目上のものとみなした。
二値変数の有効性評価項目の解析は主要評価項目と同じ方法を用い、欠測値はNRI法により補完した。
-
安全性評価項目
有害事象、死亡、重篤な有害事象、投与中止に至った有害事象などの頻度及び割合を要約した。投与0週~16週(プラセボ対照期間)以降の安全性事象データは曝露期間で調整した有害事象の発現率(100人・年あたり)を用いて要約した。当該治験薬を1回以上投与した全ての患者(投与16週以降に他の治験薬から切り替えた患者を含む)で解析した。投与0週~24週及び投与0週~52週の安全性データはいずれも事象発現時に投与されていた治験薬に基づいた。
-
※1 プラセボ群には166例がランダム化されたが、1例は投与されなかった。
※2 アプレミラストは、承認用法・用量に従い漸増後、30mg1日2回投与した。
※3 投与24週にアプレミラスト群でPASI 50を達成しなかった患者(ノンレスポンダー)は盲検下でソーティクツに切り替えた。
※4 ss-PGAのベースライン値が3以上の患者が対象
※5 PSSD症状スコアのベースライン値が1以上の患者が対象
※6 DLQIのベースライン値が2以上の患者が対象
※7 PGA-Fのベースライン値が3以上の患者が対象
-
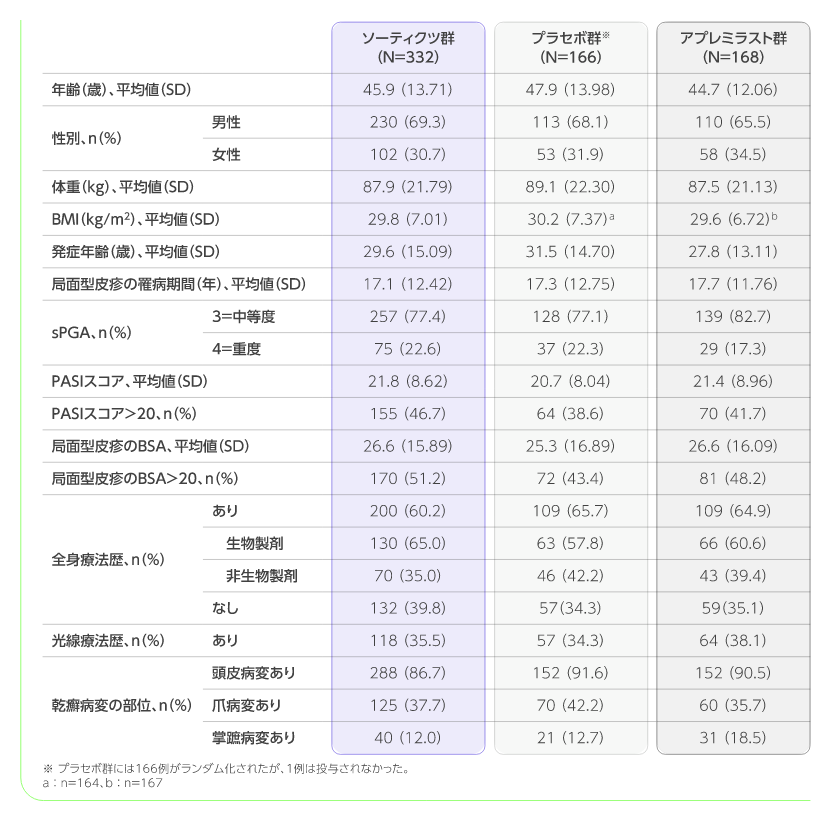
患者背景
有効性
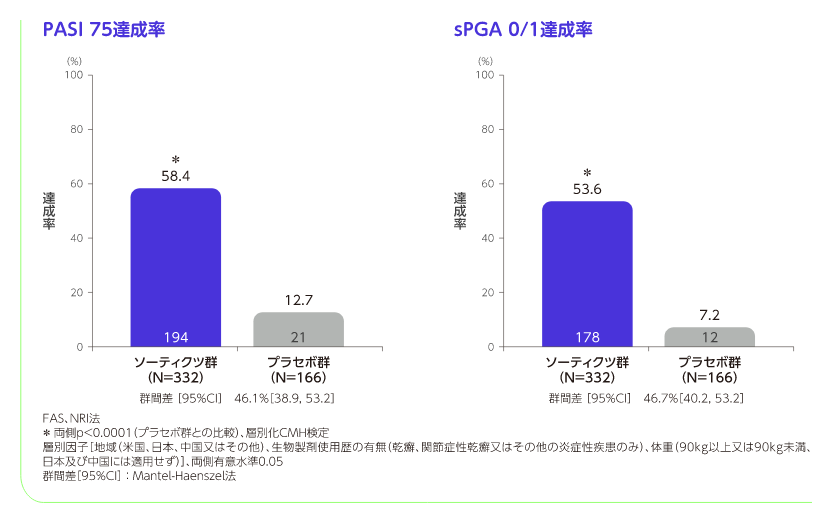
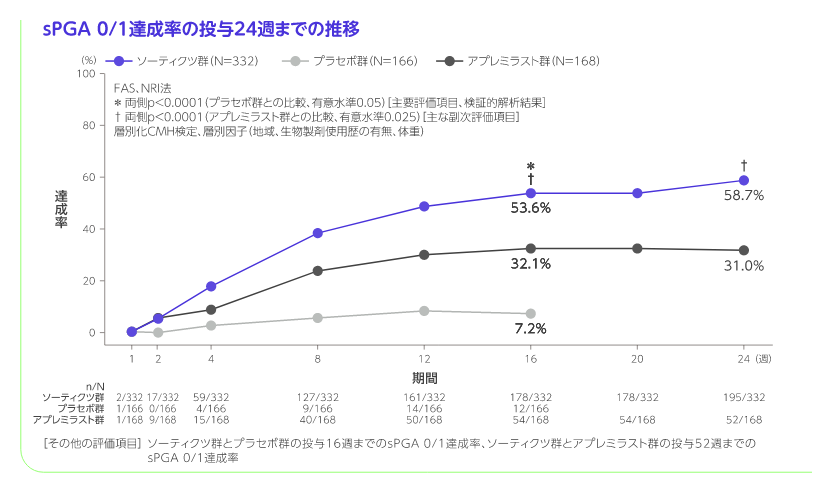
投与16週のPASI 75及びsPGA 0/1達成(ソーティクツとプラセボの比較)
[主要評価項目]、検証的解析結果
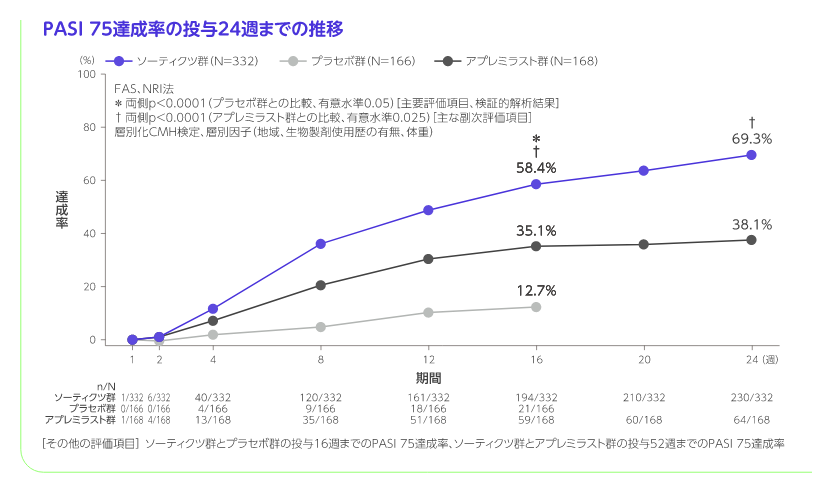
投与16週のPASI 75達成率はソーティクツ群58.4%、プラセボ群12.7%、sPGA 0/1達成率はソーティクツ群53.6%、プラセボ群7.2%であり、二つの主要評価項目で統計学的な有意差が認められ(いずれもp<0.0001、層別化CMH検定)、ソーティクツのプラセボに対する優越性が検証されました。
主な副次評価項目
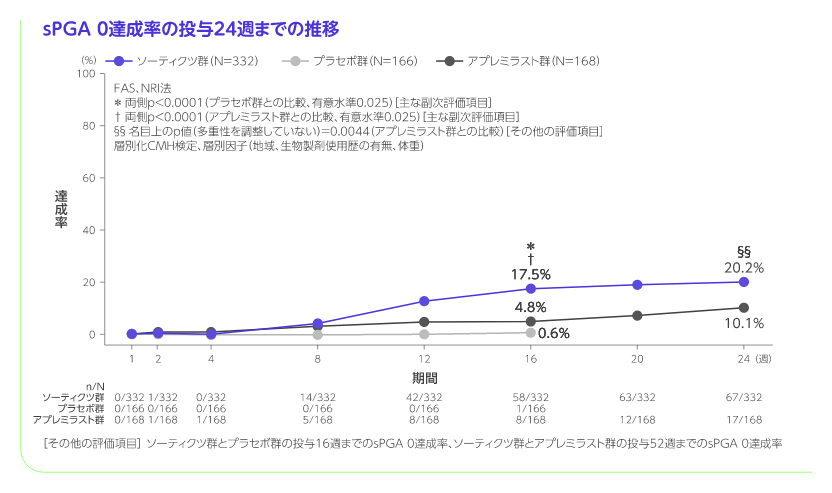
階層的検定の評価項目において、ソーティクツ群とプラセボ群との比較では6番目までの項目で統計学的有意差が認められ、7番目の項目である投与16週のPGA-F 0/1達成率がソーティクツ群20.9%、プラセボ群8.8%であり、有意差が認められず、検定が終了しました(p=0.1049、層別化CMH検定)。 また、アプレミラスト群との比較では12番目までの項目で統計学的有意差が認められ、13番目の項目である投与16週のPSSD症状スコア0達成率がソーティクツ群7.9%、アプレミラスト群4.4%であり、有意差が認められず、検定が終了しました(p=0.1702、層別化CMH検定)。
※4 ss-PGAのベースライン値が3以上の患者が対象
※5 PSSD症状スコアのベースライン値が1以上の患者が対象
※6 DLQIのベースライン値が2以上の患者が対象
※7 PGA-Fのベースライン値が3以上の患者が対象
安全性
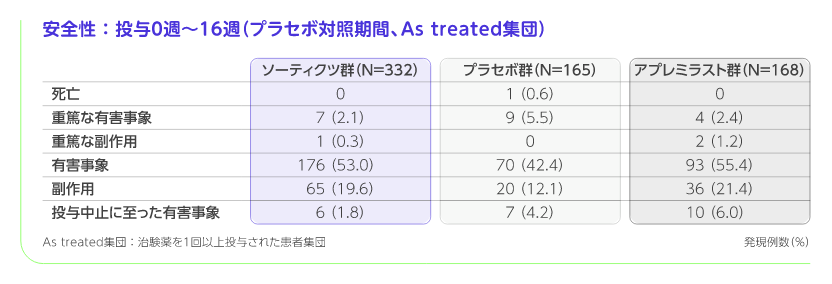
投与0週~16週(プラセボ対照期間)
・ 投与16週までの副作用の発現率は、ソーティクツ群19.6%(65/332例)、プラセボ群12.1%(20/165例)、アプレミラスト群21.4%(36/168例)でした。・ ソーティクツ群で2%以上に認められた主な副作用は、下痢(11例、3.3%)、上気道感染(7例、2.1%)、プラセボ群では、下痢(5例、3.0%)、頭痛(4例、2.4%)、アプレミラスト群では、悪心(13例、7.7%)、下痢(11例、6.5%)、頭痛(7例、4.2%)、嘔吐(4例、2.4%)でした。・ 重篤な副作用は、ソーティクツ群で1例(心筋梗塞)、アプレミラスト群で2例(限局性感染1例、冠動脈硬化症、冠動脈疾患、高血圧及び心筋梗塞が併発した1例)に認められ、プラセボ群では認められませんでした。・ 投与中止に至った副作用は、ソーティクツ群で6例(リンパ球減少症、心筋梗塞、肝機能異常、毛包炎、気分変化、乾癬が各1例)、プラセボ群で3例(食欲減退、下痢、うつ病及び頭痛が併発した1例、頭痛1例、乾癬1例)、アプレミラスト群で6例(発疹1例、下痢、悪心及び嘔吐が併発した1例、不安、下痢、悪心及び自殺念慮が併発した1例、冠動脈硬化症、冠動脈疾患、高血圧及び心筋梗塞が併発した1例、下痢、消化器痛及び紅斑が併発した1例、頭痛、悪心及び嘔吐が併発した1例)に認められました。・ 重篤な有害事象は、ソーティクツ群で7例(心筋梗塞、心室性頻脈、腹圧性尿失禁、尿管結石症、腎盂腎炎、各種物質毒性、てんかん重積状態、器質化肺炎が各1例)、プラセボ群で9例(急性心筋梗塞、不安定狭心症、高血圧性心疾患、憩室炎、転位骨折、手骨折、腱損傷、腸管皮膚瘻、腹腔内液貯留、小腸穿孔、ヘルニア穿孔、嵌頓ヘルニア、乾癬が各1例)、アプレミラスト群で4例(心筋梗塞、蜂巣炎、限局性感染、上腹部痛が各1例)に認められました。・ 投与中止に至った有害事象は、ソーティクツ群で6例(リンパ球減少症、心筋梗塞、肝機能異常、毛包炎、気分変化、乾癬が各1例)、プラセボ群で7例(頭痛2例、うつ病、乾癬、下痢、ヘルニア穿孔、糸球体濾過率減少、肝機能検査異常、食欲減退、乾癬性関節症が各1例)、アプレミラスト群で10例(下痢、悪心が各3例、嘔吐、頭痛が各2例、心筋梗塞、冠動脈硬化症、冠動脈疾患、蜂巣炎、不安、自殺念慮、乾癬、発疹、消化器痛、口唇腫脹、高血圧が各1例)に認められました。・ 本試験では、プラセボ群の1例が高血圧性心疾患により死亡し、ソーティクツ群及びアプレミラスト群では死亡は認められませんでした。
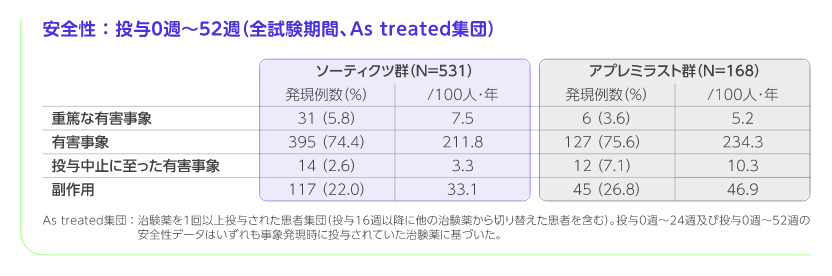
投与0週~52週(全試験期間)
・ 投与0週~52週までの副作用の発現率は、ソーティクツ群で22.0%(117/531例)、アプレミラスト群で26.8%(45/168例)でした。・ソーティクツ群で2%以上に認められた主な副作用は、下痢(14例、2.6%)、上咽頭炎(13例、2.4%)、上気道感染(12例、2.3%)、アプレミラスト群では、悪心(15例、8.9%)、下痢(11例、6.5%)、頭痛(9例、5.4%)、嘔吐(4例、2.4%)でした。・ 重篤な副作用は、ソーティクツ群で1例(心筋梗塞)、アプレミラスト群で2例(限局性感染1例、冠動脈硬化症、冠動脈疾患、高血圧及び心筋梗塞が併発した1例)に認められました。・ 投与中止に至った副作用は、ソーティクツ群で9例(リンパ球減少症、心筋梗塞、肝機能異常、毛包炎、気分変化、乾癬、糸球体濾過率減少、自然流産、発疹が各1例)、アプレミラスト群で7例(消極的思考1例、発疹1例、下痢、悪心及び嘔吐が併発した1例、不安、下痢、悪心及び自殺念慮が併発した1例、冠動脈硬化症、冠動脈疾患、高血圧及び心筋梗塞が併発した1例、下痢、消化器痛及び紅斑が併発した1例、頭痛、悪心及び嘔吐が併発した1例)に認められました。・ 重篤な有害事象は、ソーティクツ群で31例(心膜炎、急性胆嚢炎が各2例、不安定狭心症、心房細動、心筋梗塞、上室性頻脈、心室性頻脈、COVID-19、よう、伝染性単核症、咽頭扁桃炎、毛巣嚢胞、腎盂腎炎、鎖骨骨折、下肢骨折、各種物質毒性、手首関節骨折、胆石症、急性腎障害、腹圧性尿失禁、尿管結石症、労作性呼吸困難、器質化肺炎、肺塞栓症、乳癌、ホジキン病、てんかん重積状態、一過性脳虚血発作、ビタミンB12欠乏性貧血、白内障、閉塞性膵炎、変形性関節症、アルコール離脱症候群、大動脈解離が各1例)、アプレミラスト群で6例(心筋梗塞、COVID-19肺炎、蜂巣炎、限局性感染、虚血性脳卒中、上腹部痛が各1例)に認められました。・ 投与中止に至った有害事象は、ソーティクツ群で14例(感情不安定、うつ病、気分変化、心筋梗塞、心膜炎、毛包炎、術後創感染、乳癌、ホジキン病、乾癬、発疹、リンパ球減少症、肝機能異常、糸球体濾過率減少、自然流産が各1例)、アプレミラスト群で12例(下痢、悪心が各3例、嘔吐、頭痛が各2例、不安、消極的思考、自殺念慮、心筋梗塞、冠動脈硬化症、冠動脈疾患、蜂巣炎、乾癬、発疹、消化器痛、口唇腫脹、食欲減退、高血圧が各1例)に認められました。・ 本試験では、ソーティクツ群及びアプレミラスト群に死亡は認められませんでした。
- 再生時間:
- 約10分
RELATED CONTENTS 関連コンテンツ