ソーティクツ®錠6mgは、発売日の2022年11月16日から6ヵ月間、市販直後調査を実施してまいりました。先生方におかれましては、本調査にご協力を賜り、誠にありがとうございました。
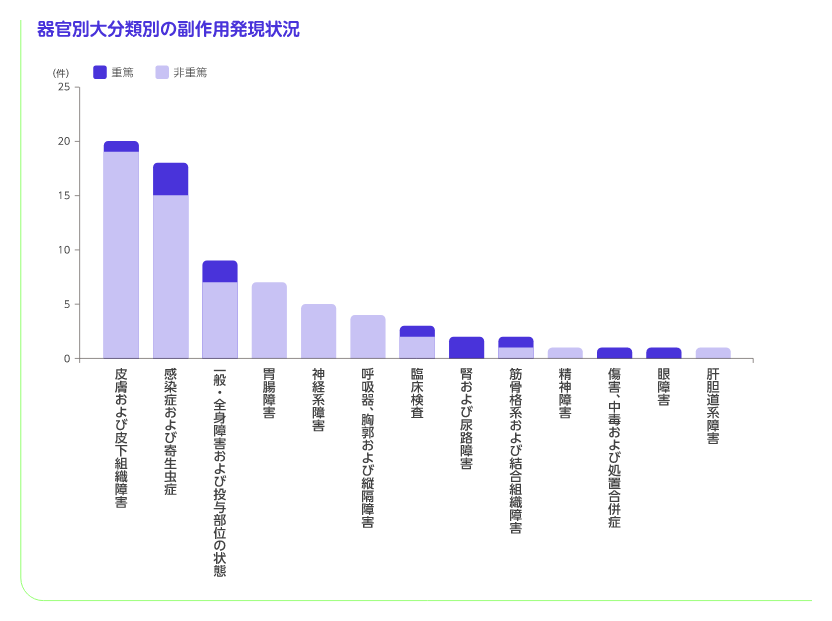
製造販売承認日である2022年9月26日から市販直後調査期間終了の2023年5月15日までに収集された副作用情報をまとめましたのでご報告申し上げます。
本剤の使用に際しましては、今後とも電子添文及び適正使用ガイド等をご参照の上、適正なご使用をお願い申し上げます。 また、本剤をご処方された患者さまに副作用が認められた場合は、速やかに弊社医薬情報担当者までご連絡いただきますよう重ねてお願い申し上げます。